MINI REVISÃO
O posto avançado contra o câncer: marcadores universais apenas para câncer
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, Yinshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd, Xangai 200233, China;2 Departamento de Cirurgia Geral, Primeiro Hospital Afiliado da Harbin Medical University, Harbin 150001, China;3Shandong Epiprobe Medical Laboratory Co., Ltd, Heze 274108, China;4 Hospital Popular da Região Autônoma de Ningxia Hui, Universidade Médica de Ningxia, Yinchuan 750002, China;5Centro Clínico de Saúde Pública de Xangai e Departamento de Cirurgia Geral, Hospital Huashan e Instituto de Metástase do Câncer e Laboratório de Epigenética de RNA, Institutos de Ciências Biomédicas, Faculdade de Medicina de Xangai, Universidade Fudan, Xangai 200032, China
ABSTRATO
O câncer é a principal causa de morte em todo o mundo.A detecção precoce do cancro pode reduzir a mortalidade de todos os tipos de cancro;no entanto, faltam biomarcadores eficazes de detecção precoce para a maioria dos tipos de câncer.A metilação do DNA sempre foi um alvo importante de interesse porque a metilação do DNA geralmente ocorre antes de outras alterações genéticas detectáveis.Ao investigar as características comuns do câncer usando um novo sequenciamento de posicionamento guia para metilação do DNA, uma série de marcadores universais somente de câncer (UCOMs) surgiram como fortes candidatos para a detecção precoce eficaz e precisa do câncer.Embora o valor clínico dos atuais biomarcadores de câncer seja diminuído pela baixa sensibilidade e/ou baixa especificidade, as características únicas dos UCOMs garantem resultados clinicamente significativos.A validação do potencial clínico dos UCOMs em cânceres de pulmão, colo do útero, endometrial e urotelial apoia ainda mais a aplicação de UCOMs em vários tipos de câncer e em vários cenários clínicos.Na verdade, as aplicações dos UCOMs estão atualmente sob investigação ativa, com avaliação adicional na detecção precoce do câncer, diagnóstico auxiliar, eficácia do tratamento e monitoramento de recorrência.Os mecanismos moleculares pelos quais os UCOMs detectam cânceres são os próximos tópicos importantes a serem investigados.A aplicação dos UCOMs em cenários do mundo real também requer implementação e refinamento.
PALAVRAS-CHAVE
Detecção de câncer;ressonância magnética;Metilação do DNA;epigenética do câncer;biomarcadores de câncer
Por que precisamos urgentemente de novos biomarcadores?
Depois de combater o cancro durante mais de um século, o cancro ainda é a ameaça biológica mais letal para a humanidade.O cancro continua a ser uma preocupação de saúde global, com 19,3 milhões de novos casos e quase 10 milhões de mortes estimadas em 20201. Em 2020, foram diagnosticados 4,6 milhões de novos casos de cancro na China, representando 23,7% dos novos casos de cancro a nível mundial, de acordo com o GLOBOCAN1.Além disso, aproximadamente 3 milhões de mortes foram atribuídas ao cancro na China em 2020, o que representou 30% das mortes globais relacionadas com o cancro1.Estas estatísticas indicaram que a China ocupa o primeiro lugar na taxa de incidência e mortalidade do cancro.Além disso, a taxa de sobrevivência ao cancro em 5 anos é de 40,5%, o que é 1,5 vezes inferior à taxa de sobrevivência em 5 anos nos Estados Unidos2,3.As taxas de sobrevivência comparativamente mais baixas e as taxas de mortalidade mais elevadas na China do que em países com índices de desenvolvimento humano mais elevados sugerem que é urgentemente necessário um sistema de prevenção e vigilância do cancro eficiente e rentável.A detecção precoce do câncer é um dos elementos mais críticos em um sistema de saúde.A detecção precoce do cancro pode melhorar o prognóstico e a sobrevivência numa fase inicial em quase todos os tipos de cancro4.Estratégias de rastreio bem-sucedidas levaram a um declínio significativo nas taxas de incidência e mortalidade dos cancros do colo do útero, da mama, colorretal e da próstata.
Alcançar a detecção precoce do câncer, no entanto, não é uma tarefa fácil.Investigar a biologia e o prognóstico do cancro precoce, identificar e validar biomarcadores de detecção precoce fiáveis e desenvolver tecnologias de detecção precoce acessíveis e precisas sempre foram os maiores obstáculos no processo4.A detecção precisa do câncer pode distinguir lesões benignas de malignas, o que ajuda a evitar procedimentos desnecessários e facilita o manejo adicional da doença.As estratégias atuais de detecção precoce incluem biópsias baseadas em endoscópio, imagens médicas, citologia, imunoensaios e testes de biomarcadores5-7.Por serem intrusivas e caras, as biópsias baseadas em endoscópio carregam um fardo inerentemente pesado como um procedimento médico importante que depende de pessoal profissional.Assim como a citologia, ambos os métodos de triagem dependem de profissionais médicos e são baseados no julgamento pessoal com desempenho longe do ideal8.Em contraste, os imunoensaios são altamente imprecisos, dadas as altas taxas de falsos positivos.A imagem médica, como tática de triagem, requer equipamentos caros e técnicos especializados.Conseqüentemente, as imagens médicas são extremamente limitadas devido à baixa acessibilidade.Por todas estas razões, os biomarcadores parecem ser a melhor opção para a detecção precoce do cancro.
Correspondência para: Yinshan Li e Wenqiang Yu
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ID ORCID: https://orcid.org/0009-0005-3340-6802 e
https://orcid.org/0000-0001-9920-1133
Recebido em 22 de agosto de 2023;aceito em 12 de outubro de 2023;
publicado on-line em 28 de novembro de 2023.
Disponível em www.cancerbiomed.org
©2023 Biologia e Medicina do Câncer.Creative Commons
Licença Internacional de Atribuição-NãoComercial 4.0
Os biomarcadores são atualmente categorizados como proteínas, marcadores de mutação de DNA, marcadores epigenéticos, anomalias cromossômicas, marcadores de RNA derivados diretamente de tumores ou fragmentos de tumor obtidos indiretamente de fluidos corporais.Os marcadores proteicos são os biomarcadores mais amplamente aplicados no rastreio e diagnóstico do cancro.Os biomarcadores proteicos, como biomarcadores de triagem, são limitados pela tendência de serem afetados por lesões benignas, o que leva ao sobrediagnóstico e ao sobretratamento, como foi relatado para a α-fetoproteína e o antígeno prostático específico (PSA)9,10.Os marcadores de RNA incluem padrões de expressão genética e outros marcadores de RNA não codificantes. Uma combinação de marcadores de RNA de expressão genética pode ser detectada usando amostras de urina, cuja sensibilidade estava longe de ser satisfatória (60%) para tumores primários, e cuja detecção pode ser afetado pela natureza de fácil degradação do RNA no ambiente normal .Marcadores genéticos e epigenéticos enfrentam o problema da prevalência em tumores e da limitação aos tipos de câncer.
A metilação do DNA tem sido uma forte candidata como biomarcador de detecção precoce desde que foi associada pela primeira vez ao câncer por Feinberg em 198312. As aberrações de metilação do DNA são observadas em todos os estágios do câncer, já no estágio pré-canceroso.A hipermetilação aberrante do DNA geralmente ocorre em ilhas CpG em promotores de genes para neutralizar os supressores de tumor .Estudos também sugeriram que a hipermetilação anormal do DNA se envolve na regulação positiva de reguladores do desenvolvimento .O vale de metilação do DNA, que é comumente associado a reguladores do desenvolvimento e cânceres hipermetilados, pode mudar o modo de expressão gênica para um modo dependente de metilação do DNA mais estável e diminuir a conexão com a histona metilada H3K27me3 e proteínas policomb associadas .
Entre o grande número de marcadores de metilação de DNA publicados, vários estrearam com sucesso no mercado;no entanto, os actuais marcadores de metilação do ADN e painéis de diagnóstico comercializados ainda não desbloquearam totalmente o potencial de detecção precoce do cancro por múltiplas razões18.Embora mostrem principalmente um desempenho aceitável usando informações de banco de dados, esses biomarcadores geralmente apresentam desempenho menos ideal no mundo real devido ao fato de que as amostras do mundo real são frequentemente mais complexas e não tão representativas quanto aquelas selecionadas nos bancos de dados.Demonstrou-se que a detecção precoce da metilação multicâncer baseada em sequenciamento de próxima geração tem uma sensibilidade de apenas 16,8% e 40,4% em cânceres em estágio I e II, respectivamente19.Os testes de detecção precoce requerem maior estabilidade e biomarcadores mais precisos.
Descoberta de marcador universal somente de câncer (UCOM) usando sequenciamento de posicionamento guia (GPS)
Apesar de décadas de investigação sobre o cancro, a prevenção e o tratamento satisfatórios não foram realizados.Novas metodologias são necessárias para permitir que os pesquisadores avaliem minuciosamente o câncer.Nos últimos 23 anos, seis características do câncer, como evitar a apoptose, invasão tecidual e metástase, etc., foram expandidas para 14, incluindo características como reprogramação epigenética não mutacional e microbiomas polimórficos .À medida que mais detalhes envolvendo o câncer são revelados, mais perspectivas são introduzidas na pesquisa do câncer.A pesquisa do câncer gradualmente entrou em uma nova era em duas direções (comunalidade e individualidade).Com o desenvolvimento da oncologia de precisão nos últimos anos, o foco da pesquisa sobre o câncer está se inclinando para a terapia direcionada individualizada e para a heterogeneidade do câncer22.Assim, os biomarcadores de câncer recentemente identificados concentraram-se principalmente em tipos específicos de câncer, como PAX6 para câncer cervical23 e BMP3 para câncer colorretal24.O desempenho desses biomarcadores específicos para os tipos de câncer varia, mas ainda não é possível que indivíduos suscetíveis sejam submetidos ao rastreamento de todos os cânceres simultaneamente devido à limitação da aquisição de amostras biológicas e ao alto custo.Seria ideal se pudéssemos identificar um biomarcador único e robusto que fosse eficaz para todos os tipos de cancro numa fase inicial.
Para atingir esse objetivo ideal, um melhor candidato a biomarcador deve ser selecionado a partir da lista de possíveis tipos de biomarcadores.As aberrações de metilação do ADN, entre todos os perfis genéticos e epigenéticos, são conhecidas por estarem relacionadas com o cancro e são algumas das primeiras, se não as primeiras, anomalias relacionadas com o cancro a ocorrerem cronologicamente.A investigação da metilação do DNA começou cedo, mas foi prejudicada pela falta de métodos de pesquisa.Entre os 28 milhões de potenciais locais CpG metilados no genoma, um número gerenciável deve ser detectado e alinhado ao genoma para melhor compreender a tumorigênese.O sequenciamento de bissulfito do genoma completo (WGBS), que é considerado o padrão ouro do sequenciamento de metilação do DNA, só pode cobrir 50% dos Cs nas células cancerígenas devido à natureza do tratamento com bissulfito que quebra fragmentos de DNA e reduz a complexidade do genoma durante o processo. a transformação de Cs-em-Ts25.Outros métodos, como chips de 450k, cobrem apenas 1,6% da metilação do genoma.Com base em dados de 450k, um painel de detecção de metilação do DNA tem sensibilidade de 35,4% para 6 tipos de câncer em estágio I26.As limitações dos tipos de câncer, o baixo desempenho e o ruído gerado pelos métodos de detecção no processo analítico tornaram-se os maiores obstáculos para os painéis de detecção de câncer.
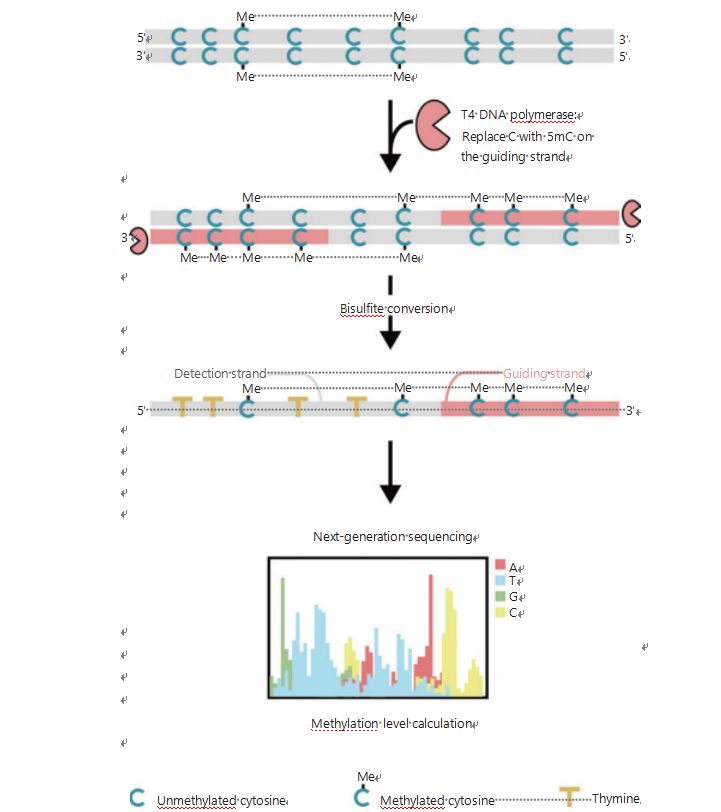
Para investigar melhor os padrões epigenéticos das células durante a tumorigênese e metástase, desenvolvemos um GPS exclusivo para detecção de metilação do DNA em todo o genoma, que cobre até 96% dos locais CpG em 0,4 bilhão de leituras .O GPS é um método de sequenciamento bilateral que utiliza uma extremidade 3 'do fragmento de DNA de metil-citosinas não conversíveis após tratamento com bissulfito que orienta o alinhamento do cálculo da metilação do DNA da extremidade 5' através do sequenciamento de pares (Figura 1) .A fita guia de metilcitosina, atuando como fita modelo, auxilia no alinhamento da região de alto GC que recupera os dados de sequenciamento mais abandonados no WGBS tradicional.O recurso de alta cobertura do GPS fornece uma enorme quantidade de informações sobre metilação do DNA, o que nos permite examinar perfis de metilação do câncer com uma resolução consideravelmente maior em regiões anteriormente pouco investigadas.
O GPS fornece-nos uma ferramenta poderosa para investigar a homogeneidade do cancro, o que pode simplificar enormemente a investigação do cancro e potencialmente encontrar uma explicação universal para a tumorigénese e a metástase.Ao analisar dados de GPS de linhas celulares de câncer, um fenômeno único foi frequentemente encontrado.Havia uma série de regiões que pareciam estar anormalmente hipermetiladas em vários tipos de amostras de câncer.Esta descoberta inesperada foi posteriormente validada para servir como UCOMs.Foram analisadas mais de 7.000 amostras de 17 tipos de câncer no banco de dados do Atlas do Genoma do Câncer (TCGA), entre as quais identificamos o primeiro UCOM, HIST1H4F, um gene relacionado a histonas que é hipermetilado em todos os tipos de câncer .Uma série de UCOMs foi então encontrada e validada no banco de dados TCGA, no banco de dados Gene Expression Omnibus (GEO) e em amostras clínicas do mundo real.A partir de agora, HIST1H4F, PCDHGB7 e SIX6 foram encontrados e validados como UCOMs.A descoberta inesperada dos UCOMs oferece uma resposta poderosa à necessidade de detecção precoce do cancro.Os UCOMs fornecem uma solução para detecção de múltiplos tipos de câncer com um único marcador.
Características dos UCOMs
Após a validação, foi demonstrado que os UCOMs exibem quatro características principais que permitem aos UCOM superar a eficácia dos biomarcadores atuais (Figura 2).
Exclusivo para malignidade
UCOMs são exclusivos de lesões cancerígenas ou pré-cancerosas e não são afetados por alterações fisiológicas normais.Alguns dos atuais marcadores relacionados ao câncer que têm sido amplamente aplicados na detecção precoce e/ou rastreamento levaram ao sobrediagnóstico.Níveis elevados de PSA, uma ferramenta de triagem clinicamente credenciada, também são detectados em condições benignas, como hiperplasia prostática e prostatite10.O sobrediagnóstico e o sobretratamento resultante levam à redução da qualidade de vida devido a complicações intestinais, urinárias e sexuais28.Outros biomarcadores baseados em proteínas e amplamente utilizados no ambiente clínico, como o CA-125, não produziram benefícios significativos, ao mesmo tempo que incorreram em sobrediagnóstico e sobretratamento29.A alta especificidade dos UCOMs para malignidades evita essas deficiências.O UCOM, PCDHGB7, distingue eficientemente lesões intraepiteliais escamosas de alto grau (HSILs) e câncer cervical de amostras normais e lesões intraepiteliais escamosas de baixo grau (LSILs), enquanto a maioria dos outros biomarcadores só podem diferenciar o câncer cervical de amostras normais30.Embora o PCDHGB7 não detecte diferenças significativas entre o endométrio normal e a hiperplasia endometrial, diferenças significativas são detectadas entre o endométrio normal e a hiperplasia atípica, e diferenças ainda maiores são detectadas entre o endométrio normal e o câncer endometrial (CE) com base no PCDHGB731.Os UCOMs são exclusivos para lesões malignas em bancos de dados e amostras clínicas.Do ponto de vista do paciente, UCOMs únicos reduzem o limiar para a compreensão de indicações complexas de vários biomarcadores instáveis de baixo desempenho e a ansiedade correspondente durante o processo de avaliação.Do ponto de vista do médico, UCOMs exclusivos diferenciam malignidades de lesões benignas, o que auxilia na triagem de pacientes e reduz procedimentos médicos desnecessários e tratamento excessivo.Portanto, UCOMs exclusivos reduzem a redundância do sistema médico, aliviam as dificuldades do sistema e disponibilizam mais recursos médicos aos necessitados.
Figura 1 Esquema do fluxo de trabalho do GPS para detecção de metilação do DNA25.Linha cinza: sequência de DNA de entrada;linha vermelha: DNA tratado com DNA polimerase T4, substituindo citosina por 5'-metilcitosina na extremidade 3' da entrada;azul C comigo: citosina metilada;azul C: citosina não metilada;amarelo T: timina25.
Tudo ou nada
Os UCOMs estão presentes apenas em células cancerígenas e são detectados de forma estável em quase todas as células cancerígenas.O HIST1H4F foi validado para ser hipermetilado em quase todos os tipos de tumor, mas não em amostras normais27.Da mesma forma, PCDHGB7 e SIX6 também demonstraram estar hipermetilados em todas as amostras de tumor, mas não em amostras normais .Esta característica única melhora significativamente o desempenho dos UCOMs no que diz respeito ao limite de detecção e sensibilidade.Apenas 2% das células cancerosas podem ser diferenciadas em amostras, tornando os UCOMs um biomarcador muito mais sensível do que a maioria dos biomarcadores existentes30. Como biomarcador usado para detecção de câncer colorretal, as mutações KRAS existem apenas em aproximadamente 36% dos casos de câncer colorretal, sugerindo baixo potencial diagnóstico33.A baixa prevalência de mutações do KRAS no câncer colorretal limita o KRAS em combinação com outros biomarcadores.Na verdade, uma combinação de biomarcadores pode parecer promissora inicialmente, mas nem sempre gera um resultado satisfatório, ao mesmo tempo que demonstra um ruído muito maior na análise de detecção e geralmente envolve procedimentos experimentais mais complicados.Em contraste, o PCDHGB7 e outros UCOMs existem em todos os tipos de câncer.Os UCOMs detectam componentes cancerígenos em diferentes tipos de amostras de câncer com a máxima precisão, ao mesmo tempo que erradicam processos complexos de análise de cancelamento de ruído.Não é difícil detectar câncer em uma amostra abundante, mas é extremamente desafiador detectar câncer em uma amostra pequena.UCOMs são capazes de detectar pequenas quantidades de câncer.
Figura 2 Características dos UCOMs.
Detecção de câncer precedendo alterações patológicas
UCOMs podem ser detectados na fase pré-cancerosa, antes das alterações patológicas.Como biomarcadores epigenéticos, as anormalidades da UCOM ocorrem em um estágio anterior às anormalidades fenotípicas e são detectáveis durante a tumorigênese, progressão e metástase34,35.A sensibilidade do UCOM ao longo do tempo melhora o desempenho do UCOM na detecção de câncer em estágio inicial e lesões pré-cancerosas.A detecção do câncer precoce com base em biópsias e citologia pode ser difícil até mesmo para os patologistas mais experientes.Uma única biópsia adquirida por colposcopia foi relatada como positiva em 60,6% das amostras HSIL+.Biópsias adicionais são necessárias para lesões múltiplas para aumentar a sensibilidade36.Em contrapartida, o UCOM, PCDHGB7, tem sensibilidade de 82% para amostras HSIL+, superando a sensibilidade das biópsias e da maioria dos biomarcadores30.O marcador de metilação, FAM19A4, tem sensibilidade de 69% para NIC2+, o que é semelhante à citologia, mas não consegue diferenciar NIC1 de amostras normais37.Os UCOMs demonstraram ser um biomarcador de detecção precoce muito mais sensível.Em comparação com patologistas baseados na experiência, os UCOMs têm sensibilidade de detecção superior para cancros em fase inicial, o que por sua vez contribui para melhorar o prognóstico e a sobrevivência do cancro30.Além disso, os UCOMs oferecem uma plataforma de detecção acessível a áreas sem patologistas experientes e que melhora muito a eficiência da detecção.Com procedimentos uniformes de amostragem e detecção, a detecção UCOM produz resultados estáveis e fáceis de interpretar que melhor se adaptam a um protocolo de triagem que exige menos pessoal profissional e recursos médicos.
Fácil de detectar
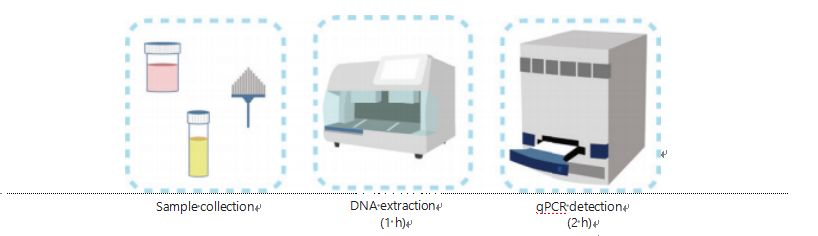
Os métodos atuais para detecção de metilação do DNA são complicados e demorados.A maioria dos métodos requer transformação de bissulfito, o que causa perda na qualidade da amostra e possivelmente produz resultados instáveis e imprecisos.A baixa reprodutibilidade causada pelo tratamento com bissulfito pode causar confusão para médicos e pacientes e interferir ainda mais no acompanhamento e/ou estratégias de tratamento.Portanto, modificamos ainda mais o método de detecção de UCOM para evitar o tratamento problemático das amostras com bissulfito, acomodar os requisitos de aplicação clínica e melhorar a acessibilidade.Desenvolvemos um novo método usando enzimas de restrição sensíveis à metilação combinadas com PCR quantitativo fluorescente em tempo real (Me-qPCR) para quantificar o status de metilação dos UCOMs dentro de 3 horas usando procedimentos de fácil manuseio (Figura 3).O Me-qPCR pode acomodar vários tipos de amostras, como coleta clínica de fluidos corporais e amostras de urina auto-coletadas.As amostras clínicas coletadas podem ser processadas, armazenadas e prosseguir facilmente para detecção usando extração de DNA padronizada e automatizada.O DNA extraído pode então ser aplicado diretamente à plataforma Me-qPCR para uma reação única e resultados de quantificação de saída.Após análise simples dos resultados utilizando modelos de diagnóstico ajustados e validados para tipos específicos de câncer, a determinação final dos resultados de detecção do UCOM é interpretada e apresentada como um valor semiquantitativo.A plataforma Me-qPCR supera o tradicional pirosequenciamento de bissulfito na detecção de UCOM, economizando 3 horas de conversão de bissulfito, de acordo com o protocolo do kit EZ DNA Methylation-Gold.A inovadora plataforma de detecção de metilação torna a detecção UCOM mais estável, mais precisa e mais acessível30.
Figura 3 Processo de detecção de UCOMs.Os tipos de amostras incluem BALF amostrado profissionalmente, escova de Papanicolau e/ou urina auto-coletada.O processo de extração de DNA pode ser acomodado em um extrator automático, cujo produto pode ser detectado diretamente por qPCR.
Aplicação de UCOMs
Câncer de pulmão
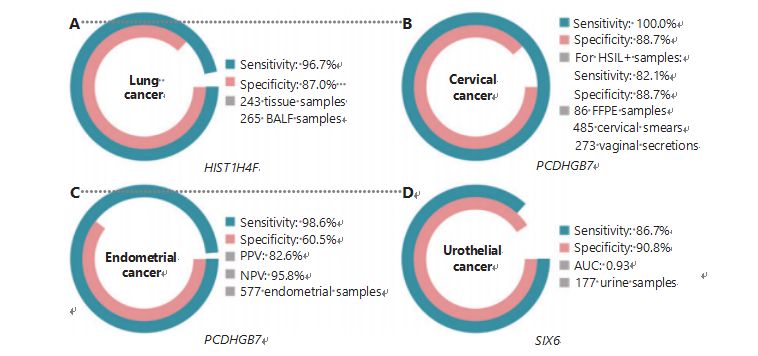
O cancro do pulmão é o segundo cancro mais frequentemente diagnosticado e mais letal em todo o mundo, sendo responsável por 11,4% dos novos casos e 18,0% das novas mortes1.Entre todos os diagnósticos, 85% são câncer de pulmão de células não pequenas (CPNPC) e 15% são câncer de pulmão de células pequenas (CPPC), que apresenta maior nível de malignidade38.A tomografia computadorizada de baixa dose (TCLD) é o método de rastreamento atualmente recomendado para câncer de pulmão e demonstrou melhorar a detecção precoce e reduzir a mortalidade6;no entanto, devido à baixa especificidade e à fraca acessibilidade, a LDCT ainda não serviu como um método de rastreio satisfatório, tal como outros marcadores comuns de cancro, como o CEA39.Os custos e o potencial de diagnósticos falhados e erros de diagnóstico da estratégia de rastreio por TCBD impedem o progresso da promoção do rastreio do cancro do pulmão40.HIST1H4F, um UCOM, tem enorme potencial como biomarcador de detecção precoce em amostras de líquido broncoalveolar (LBA)27.O HIST1H4F é hipermetilado no adenocarcinoma pulmonar e no carcinoma espinocelular do pulmão, com especificidade de detecção de 96,7% e sensibilidade de 87,0% (Figura 4A), e desempenho excepcional para cânceres em estágio I27.O HIST1H4F tem especificidade de 96,5% e sensibilidade de 85,4% para CPNPC e 96,5% e 95,7%, respectivamente, para CPPC27.Além disso, amostras de outros oito tipos de câncer, incluindo câncer pancreático e colorretal, validaram que o HIST1H4F está hipermetilado em todos os oito tipos27.
Câncer cervical
O cancro do colo do útero foi o quarto cancro mais frequentemente diagnosticado e a quarta principal causa de mortes por cancro nas mulheres em 2020, sendo responsável por 3,1% dos novos casos e 3,4% das mortes relacionadas com o cancro a nível mundial1.Para eliminar o cancro do colo do útero até 2030, conforme proposto pela OMS, a detecção precoce do cancro do colo do útero é uma necessidade.Se detectada precocemente, a taxa de sobrevivência em 5 anos chega a 92% com câncer cervical invasivo41.As diretrizes da American Cancer Society (ACS) sugerem testes de citologia cervical, testes primários de HPV ou cotestes para triagem42.A citologia cervical é invasiva e só consegue detectar 63,5% dos casos de NIC2+37.
O PCDHGB7, por outro lado, teve um desempenho muito melhor usando exames de Papanicolaou e secreções vaginais, e pode diferenciar com eficiência HSIL de LSIL em um estágio ultra-precoce.O PCDHGB7 sozinho tem sensibilidade de 100,0% e especificidade de 88,7% para câncer cervical (Figura 4B), e sensibilidade de 82,1% e especificidade de 88,7% para amostras HSIL+30.O PCDHGB7 também apresenta sensibilidade de 90,9% e especificidade de 90,4% em amostras de secreção vaginal para câncer cervical, que são muito mais fáceis de coletar30.Quando combinado com o teste HPV de alto risco (hr) ou o teste de citologia Thinprep (TCT), o PCDHGB7 tem uma sensibilidade aumentada de 95,7% e especificidade de 96,2%, superando significativamente a do teste hrHPV (20,3%), TCT (51,2% ), e os dois combinados (57,8%) para câncer de colo de útero30.Também foi demonstrado que o PCDHGB7 está hipermetilado em 17 tipos de câncer do banco de dados TCGA, indicando sua adequação na família UCOM30.
Figura 4 Os UCOMs foram validados em quatro tipos de câncer em estudos clínicos em larga escala.A. Desempenho do HIST1H4F, um UCOM, na detecção de câncer de pulmão em 508 amostras.B. Desempenho do PCDHGB7, um UCOM, na detecção de câncer cervical em 844 amostras.C. Desempenho do PCDHGB7, um UCOM, na detecção de câncer endometrial em 577 amostras endometriais de Pap e Tao Brush.D. Desempenho do SIX6, um UCOM, na detecção de câncer urotelial de 177 amostras.
EC
A CE é um dos cancros do sistema reprodutor feminino mais comuns em todo o mundo, com uma estimativa de 4,2 milhões de novos casos e 1% das mortes relacionadas com o cancro anualmente1.Com um diagnóstico bem-sucedido em um estágio inicial, a CE é curável e tem uma taxa de sobrevivência em 5 anos de 95% para o câncer em estágio I.Pacientes sintomáticos, como sangramento uterino anormal, recebem avaliação clínica periódica e são submetidos a procedimentos de biópsia invasivos e dolorosos, apesar de apenas 5% a 10% eventualmente desenvolverem CE43.A ultrassonografia transvaginal, como método de detecção comum, é altamente não confiável devido à sua incapacidade de diferenciar alterações endometriais benignas de malignas e à alta taxa de falsos positivos44.
Foi realizada uma comparação paralela do CA-125 sérico, um biomarcador EC amplamente implementado, e do PCDHGB7.O CA-125 sérico apresentou sensibilidade de 24,8%, o que sugere que o CA-125 é um marcador inadequado para CE, apesar de uma especificidade de 92,3%31.A detecção de PCDHGB7 usando amostras de escova de Papanicolau apresentou sensibilidade de 80,65% e especificidade de 82,81% para estágios ECatall, enquanto uma escova Tao apresentou sensibilidade de 61,29% e especificidade de 95,31%31.O modelo diagnóstico PCDHGB7, baseado em Me-qPCR, apresentou sensibilidade de 98,61%, especificidade de 60,5% e acurácia geral de 85,5%, utilizando amostras de escova Pap e Tao (Figura 4C)31.
Câncer urotelial
O câncer urotelial, composto pelos cânceres de bexiga, pelve renal e ureter, foi o sétimo câncer mais frequentemente diagnosticado em 2020 em todo o mundo, causando 5,2% dos novos casos e 3,9% das mortes1.Os cancros uroteliais, dos quais mais de 50% são cancro da bexiga, foram o quarto cancro mais frequentemente diagnosticado nos Estados Unidos em 2022, representando 11,6% dos casos recentemente diagnosticados3.Aproximadamente 75% dos cânceres de bexiga são classificados como câncer de bexiga não invasivo muscular restrito à mucosa ou submucosa45.Uma biópsia cistoscopia é o padrão ouro para o diagnóstico de câncer urotelial implementado por hibridização in situ fluorescente (FISH) e testes de citologia.FISH e citologia têm baixo desempenho diagnóstico, e a cistoscopia é intrusiva e tem o risco subjacente de perder microlesões, interpretar mal as lesões e potencialmente causar uma propagação ou recidiva do câncer46.O UCOM previamente validado, PCDHGB7, também mostrou estar hipermetilado no câncer urotelial, com área sob a curva de 0,86, sugerindo uma potencial capacidade diagnóstica30.Para validar ainda mais UCOMs e acomodar melhor mais tipos de amostras, o SIX6, um novo UCOM, foi examinado e mostrou excelente potencial diagnóstico na detecção precoce de câncer urotelial usando amostras de urina na plataforma Me-qPCR.A detecção de SIX6 utilizando amostras de urina demonstrou sensibilidade competitiva de 86,7% e especificidade de 90,8% (Figura 4D), sendo não invasiva e fácil de adquirir32.O potencial do SIX6 no monitoramento de metástases e avaliação da eficácia do tratamento está atualmente sob investigação.
O futuro e os desafios
Os UCOMs têm um forte desempenho no potencial diagnóstico de múltiplos cancros, mas ainda há muito trabalho a fazer.Temos expandido a lista de UCOMs e validado ativamente os UCOMs em mais tipos de câncer, incluindo aqueles que são tradicionalmente difíceis de detectar.Os resultados da validação das bases de dados TCGA corroboraram ainda mais a aplicação dos UCOMs em mais tipos de câncer e em mais situações.Numa investigação preliminar, foi demonstrado que os UCOMs têm um potencial diagnóstico robusto para colangiocarcinomas e adenocarcinomas pancreáticos, que são quase impossíveis de diagnosticar numa fase inicial com os métodos de rastreio atuais32,47.A capacidade de detectar cânceres raros com UCOMs pode ser utilizada com DNA tumoral circulante (ctDNA) por uma plataforma aprimorada de biópsia líquida48.Um estudo envolvendo um painel de detecção de câncer pandêmico baseado em DNA plasmático produziu uma sensibilidade de 57,9%49.Apesar da elevada especificidade, o desempenho global revela que ainda há espaço para melhorias.
As características únicas dos UCOMs também apoiaram a investigação do potencial do UCOM na avaliação da eficácia do tratamento e no monitoramento de recorrências.De acordo com os Critérios de Avaliação de Resposta em Tumores Sólidos (RECIST), a imagem médica é a metodologia recomendada para monitoramento de recorrência e avaliação da eficácia do tratamento, enquanto os marcadores tumorais são usados isoladamente para avaliação50.Na realidade, porém, as abordagens de imagem são muito afetadas pela frequência e pelo tempo e, portanto, expõem os pacientes a maiores riscos e custos51,52.O SIX6 foi validado para servir como preditor de metástase de câncer de mama32.O monitoramento de ctDNA baseado em biópsia líquida permite a vigilância em tempo real de doenças residuais mínimas meses antes da detecção radiológica, atrasando e prevenindo idealmente a progressão do câncer relacionada à recidiva53.Resultados preliminares sugerem que as UCOMs refletem o nível de hipermetilação cancerosa em tempo real imediatamente após a cirurgia e o tratamento32.A alta sensibilidade exibida pelos UCOMs e a aplicabilidade em vários tipos de amostras não intrusivas permitem que os UCOMs sirvam como um biomarcador preciso de monitoramento de recorrência, mantendo ao mesmo tempo uma alta adesão do paciente.
Ao mesmo tempo, a acessibilidade pública ao teste é outra questão importante que exige esforços adicionais.Embora as colaborações de detecção UCOM tenham sido adoptadas em mais hospitais na esperança de beneficiar mais pacientes, detecções e rastreios pro bono têm sido realizados activamente na China rural.Os UCOMs exigem melhor acessibilidade para serem considerados uma ferramenta de triagem viável, especialmente para áreas subdesenvolvidas.
Embora os resultados do aplicativo UCOM na detecção precoce sejam promissores, existem muitas incógnitas sobre o UCOM.Com a exploração ativa, são necessárias pesquisas adicionais sobre por que os UCOMs estão universalmente presentes nos cânceres.Os mecanismos de regulação epigenética subjacentes aos UCOMs merecem uma investigação mais aprofundada, o que poderia justificar uma nova direcção para a terapêutica do cancro.Voltando à interação entre homogeneidade e heterogeneidade tumoral, estamos interessados em saber por que os UCOMs podem ser uma exceção à maioria dos biomarcadores de câncer que estão intimamente ligados a tipos específicos de câncer.O papel das aberrações de metilação do DNA identificadas pelo UCOM na tumorigênese, progressão tumoral e metástase não foi determinado no processo de perda e recuperação da identidade celular e necessita de uma inspeção completa.Outro grande interesse reside no escopo da incorporação do traço de homogeneidade dos UCOMs com marcadores exclusivos de tecido, na esperança de abordar a detecção precisa de vestígios de câncer e a identificação das origens do tecido tumoral de maneira reversa.Os UCOMs podem ser uma ferramenta ideal para prevenir o câncer, detectá-lo e, potencialmente, defender e eliminar o câncer.
Conceder apoio
Este trabalho foi apoiado pelo Programa Nacional de P&D Chave da China (Grant No. 2022BEG01003), pela Fundação Nacional de Ciências Naturais da China (Grant Nos. 32270645 e 32000505), uma bolsa da Comissão Provincial de Saúde de Heilongjiang (Grant No. 2020-111) e uma bolsa do Heze Science and Technology Institute (bolsa nº 2021KJPT07).
Declaração de conflito de interesse
Wei Li é o Diretor de P&D da Shanghai Epiprobe Biotechnology Co., Ltd. Wenqiang Yu atua no Conselho Consultivo Científico da Epiprobe.W. Yu e Epiprobe aprovaram patentes pendentes relacionadas a este trabalho.Todos os outros autores declaram não haver interesses conflitantes.
Contribuições do autor
Concebeu e desenhou o projeto: Chengchen Qian e Wenqiang Yu.
Escreveu o artigo: Chengchen Qian.
Fez as ilustrações: Chengchen Qian.
Revisou e editou o manuscrito: Xiaolong Zou, Wei Li, Yinshan Li e Wenqiang Yu.
Referências
1. Sung H, Ferlay J, Siegel RL, LaversanneM, Soerjomataram I, Jemal A, et al.Estatísticas Globais do Câncer 2020: Estimativas GLOBOCAN de
incidência e mortalidade mundial para 36 tipos de câncer em 185 países.CA Câncer J Clin.2021;71: 209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S, et al.Estatísticas do câncer na China e nos Estados Unidos, 2022: perfis, tendências e determinantes.Chin MedJ (Inglês).2022;135: 584-90.
3. Siegel RL, Miller KD, WagleNS, JemalA.Estatísticas de câncer, 2023. CA Cancer J Clin.2023;73: 17-48.
4. Crosby D, BhatiaS, Brindle KM, Coussens LM, Dive C, Emberton M, et al.Detecção precoce do câncer.Ciência.2022;375: eaay9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.Estratégias para
rastreamento do câncer colorretal.Gastroenterologia.2020;158: 418-32.
6. Tanoue LT, Tanner NT, Gould MK, Silvestri GA.Rastreamento do câncer de pulmão.Sou J Respir Crit Care Med.2015;191: 19-33.
7. Bouvard V, WentzensenN, Mackie A, Berkhof J, BrothertonJ, Giorgi-Rossi P, et al.A perspectiva da IARC sobre o rastreio do cancro do colo do útero.N EnglJ Med.2021;385: 1908-18.
8. Xue P, Ng MTA, QiaoY.Os desafios da colposcopia para rastreio do cancro do colo do útero em países de baixa e média renda e soluções por inteligência artificial.BMC Med.2020;18: 169.
9. Johnson P, Zhou Q, Dao DY, Lo YMD.Biomarcadores circulantes no diagnóstico e tratamento do carcinoma hepatocelular.Nat Rev Gastroenterol Hepatol.2022;19: 670-81.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. Detecção precoce do câncer de próstata baseada em PSA no soro na Europa e no mundo: passado, presente e futuro.Nat Rev Urol.2022;19:
562-72.
11. HolyoakeA, O'Sullivan P, Pollock R, Best T, Watanabe J, KajitaY,
e outros.Desenvolvimento de um teste multiplex de RNA na urina para detecção e estratificação de carcinoma de células transicionais da bexiga.Clínica Câncer Res.2008;14: 742-9.
12. Feinberg AP, Vogelstein B. A hipometilação distingue genes de alguns cânceres humanos de suas contrapartes normais.Natureza.1983;301: 89-92.
13. Ng JM, Yu J. Promotor de hipermetilação de genes supressores de tumor como potenciais biomarcadores no câncer colorretal.IntJ Mol Sci.2015;16: 2472-96.
14. Esteller M. Epigenômica do câncer: metilomas de DNA e mapas de modificação de histonas.Nat Rev Genet.2007;8: 286-98.
15. Nishiyama A, Nakanishi M. Navegando no cenário de metilação do DNA do câncer.Tendências Genet.2021;37: 1012-27.
16. Xie W, Schultz MD, ListerR, Hou Z, Rajagopal N, Ray P, et al.Análise epigenômica da diferenciação multilinhagem de células-tronco embrionárias humanas.Célula.2013;153: 1134-48.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X, et al.Análises de todo o genoma revelam um papel do Polycomb na promoção da hipometilação dos vales de metilação do DNA.Genoma Biol.2018;19:18.
18. Koch A, JoostenSC, Feng Z, de Ruijter TC, DrahtMX, MelotteV,
e outros.Análise da metilação do DNA no câncer: localização revisitada.Nat Rev Clin Oncol.2018;15: 459-66.
19. KleinEA, Richards D, Cohn A, TummalaM, Lapham R, Cosgrove D, et al.Validação clínica de um teste de detecção precoce multicâncer baseado em metilação direcionado usando um conjunto de validação independente.Ana Oncol.2021;32: 1167-77.
20. Hanahan D, Weinberg RA.As marcas do câncer.Célula.2000;100: 57-70.
21. Hanahan D. Marcas do câncer: novas dimensões.Câncer Descoberta.2022;12:31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. Oncologia de precisão: quem, como, o quê, quando e quando não?Livro Am Soc Clin Oncol Educ.2017: 160-9.
23. Liu H, Meng X, Wang J. Metilação quantitativa em tempo real
detecção do gene PAX1 no rastreamento do câncer cervical.IntJ Gynecol Câncer.2020;30: 1488-92.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP, et al.Teste de DNA multitargetstool para rastreamento de câncer colorretal.N EnglJ Med.2014;370: 1287-97.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S, et al.Posicionamento do guia
o sequenciamento identifica padrões aberrantes de metilação do DNA que alteram a identidade celular e as redes de vigilância imune ao tumor.Genoma
Res.2019;29: 270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY, et al.Detecção não intrusiva de múltiplos cânceres por sequenciamento de metilação de DNA livre de células circulantes (THUNDER): desenvolvimento e estudos de validação independentes.Ana Oncol.2023;34: 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B, et al.Genes relacionados às histonas são hipermetilados no câncer de pulmão e hipermetilados
HIST1H4F poderia servir como um biomarcador pan-câncer.Câncer Res.2019;79: 6101-12.
28. HeijnsdijkEA, Wever EM, AuvinenA, Hugosson J, Ciatto S, Nelen V, et al.Efeitos na qualidade de vida da triagem de antígeno específico da próstata.N EnglJ Med.2012;367: 595-605.
29. LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. Eficácia clínica de testes de biomarcadores de rastreio do cancro oferecidos como serviço de saúde auto-pago: uma revisão sistemática.Eur J Saúde Pública.2016;26: 498-505.
30. Dong S, Lu Q, Xu P, Chen L, Duan X, Mao Z, et al.
PCDHGB7 hipermetilado como marcador universal apenas de câncer e sua aplicação no rastreamento precoce do câncer cervical.Clin Transl Med.2021;11: e457.
31. Yuan J, Mao Z, Lu Q, Xu P, Wang C, Xu X, et al.PCDHGB7 hipermetilado como biomarcador para detecção precoce de câncer endometrial em amostras de escova endometrial e raspados cervicais.Frente Mol Biosci.2022;8: 774215.
32. Dong S, Yang Z, Xu P, Zheng W, Zhang B, Fu F, et al.Mutuamente
modificação epigenética exclusiva em SIX6 com hipermetilação para estágio pré-canceroso e rastreamento de emergência de metástase.Alvo de transdução de sinal Ther.2022;7: 208.
33. Huang L, Guo Z, Wang F, Fu L. Mutação KRAS: de indrogável a drogado no câncer.Alvo de transdução de sinal Ther.2021;6: 386.
34. Belinsky SA, Nikula KJ, PalmisanoWA, MichelsR, SaccomannoG, GabrielsonE, et al.A metilação aberrante de p16 (INK4a) é um evento precoce no câncer de pulmão e um potencial biomarcador para diagnóstico precoce.Proc Natl Acad Sci U SA.1998;95: 11891-6.
35. Robertson KD.Metilação do DNA e doenças humanas.Nat Rev Genet.2005;6: 597-610.
36. WentzensenN, Walker JL, Gold MA, Smith KM, ZunaRE,
Mathews C, et al.Múltiplas biópsias e detecção de precursores do câncer cervical na colposcopia.J Clin Oncol.2015;33: 83-9.
37. De Strooper LM, Meijer CJ, Berkhof J, Hesselink AT, Snijders
PJ, Steenbergen RD, et al.Análise de metilação do FAM19A4
gene em raspados cervicais é altamente eficiente na detecção de
carcinomas e lesões avançadas de NIC2/3.Câncer Prev Res (Phila).2014;7: 1251-7.
38. Thai AA, Solomon BJ, Sequist LV, Gainor JF, Heist RS.Câncer de pulmão.Lanceta.2021;398: 535-54.
39. Grunnet M, Sorensen JB.Antígeno carcinoembrionário (CEA) como marcador tumoral em câncer de pulmão.Câncer de pulmão.2012;76: 138-43.
40. Madeira DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L, et al.Triagem de câncer de pulmão, versão 3.2018, Diretrizes de prática clínica da NCCN em oncologia.J Natl Compr Canc Netw.2018;16: 412-41.
41. Sociedade Americana do Câncer.Fatos e números sobre o câncer.Atlanta, GA, EUA: Sociedade Americana do Câncer;2023 [atualizado em 1º de março de 2023;citado em 2023, 22 de agosto].
42. FonthamETH, Wolf AMD, Igreja TR, EtzioniR, Flowers CR,
Herzig A, et al.Rastreamento do câncer cervical para indivíduos com risco médio: atualização das diretrizes de 2020 da American Cancer Society.CA Câncer J Clin.2020;70: 321-46.
43. Clarke MA, Long BJ, Del Mar MorilloA, Arbyn M, Bakkum-Gamez JN, Wentzensen N. Associação de risco de câncer endometrial com sangramento pós-menopausa em mulheres: uma revisão sistemática e meta-análise.JAMA Estagiário Med.2018;178: 1210-22.
44. Jacobs I, Gentry-MaharajA, Burnell M, ManchandaR, Singh N,
Sharma A, et al.Sensibilidade da triagem ultrassonográfica transvaginal
para câncer endometrial em mulheres na pós-menopausa: um estudo de caso-controle dentro da coorte UKCTOCS.Lanceta Oncol.2011;12:38-48.
45. BabjukM, Burger M, CompératEM, Gontero P, MostafidAH,
PalouJ, et al.Diretrizes da Associação Europeia de Urologia sobre Câncer de Bexiga Não Invasivo Muscular (TaT1 e Carcinoma In Situ) -
Atualização de 2019.Eur Urol.2019;76: 639-57.
46. Aragão-Ching JB.Desafios e avanços no diagnóstico, biologia e tratamento dos carcinomas uroteliais do trato superior e da bexiga.Urol Oncol.2017;35: 462-4.
47. Rizvi S, KhanSA, Hallemeier CL, Kelley RK, Gores GJ.
Colangiocarcinoma – evolução de conceitos e estratégias terapêuticas.Nat Rev Clin Oncol.2018;15: 95-111.
48. Ye Q, Ling S, Zheng S, Xu X. Biópsia líquida em hepatocelular
carcinoma: células tumorais circulantes e DNA tumoral circulante.Mol Câncer.2019;18: 114.
49. Zhang Y, Yao Y, Xu Y, Li L, Gong Y, Zhang K, et al.Pan-câncer
detecção de DNA tumoral circulante em mais de 10.000 pacientes chineses.Nat Comun.2021;12:11.
50. Eisenhauer EA, Therasse P, BogaertsJ, Schwartz LH, Sargent D, Ford R, et al.Novos critérios de avaliação de resposta em tumores sólidos: diretriz RECIST revisada (versão 1.1).Eur J Câncer.2009;45: 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST - aprender com o passado para construir o futuro.Nat Rev Clin Oncol.
2017;14: 187-92.
52. Seymour L, BogaertsJ, Perrone A, FordR, Schwartz LH, Mandrekar S, et al.iRECIST: diretrizes para critérios de resposta para uso em ensaios
testando imunoterápicos.Lanceta Oncol.2017;18: e143-52.
53. PantelK, Alix-Panabières C. Biópsia líquida e doença residual mínima – últimos avanços e implicações para a cura.Nat Rev Clin Oncol.2019;16: 409-24.
Como citar este artigo: Qian C, Zou X, Li W, Li Y, Yu W. O posto avançado contra o câncer: marcadores universais apenas para câncer.Câncer Biol Med.2023;20: 806-815.
doi: 10.20892/j.issn.2095-3941.2023.0313
Horário da postagem: 07 de maio de 2024